Page 37 - Fen Lisesi Kimya 11
P. 37
MODERN ATOM TEORİSİ
Küresel simetri elektron dizilimine sahip elementler kararlı oldukla-
rından elektron koparmak için gerekli olan iyonlaşma enerjileri de yük-
sektir. Aynı periyotta birinci iyonlaşma enerjisi en küçük 1A grubu en
büyük 8A grubu elementleridir.
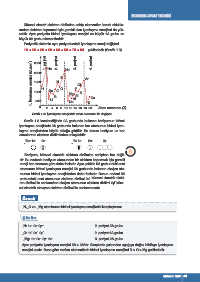
Periyodik sistemin aynı periyodundaki iyonlaşma enerji değişimi
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A şeklindedir (Grafik 1.3).
2. periyot
3. periyot
4. periyot
1. periyot
2500
1. İyonlaşma enerjisi (kJ.mol -1 ) 2000 H He N F Ne Mg P CI S Ar
1500
O
Be C
1000
Si
500
0 2 Li B Na Al K Ca Atom numarası (Z)
4 6 8 10 12 14 16 18 20
Grafk 1.3: İyonlaşma enerjisinin atom numarası ile değişimi
Grafik 1.3 incelendiğinde 2A grubunda bulunan berilyumun birinci
iyonlaşma enerjisinin 3A grubunda bulunan bor atomunun birinci iyon-
laşma enerjisinden büyük olduğu görülür. Bu durum berilyum ve bor
atomlarının elektron diziliminden anlaşılabilir.
2
2
2
Be: 1s 2 2s B: 1s 2s 2p 1
4 5
Berilyum, küresel simetrik elektron dizilimine sahipken bor değil-
dir. Bu nedenle berilyum atomundan bir elektron koparmak için gerekli
enerji bor atomuna göre daha fazladır. Aynı şekilde 5A grubundaki azot
atomunun birinci iyonlaşma enerjisi 6A grubunda bulunan oksijen ato-
munun birinci iyonlaşma enerjisinden daha fazladır. Bunun nedeni 5A
3
grubundaki azot atomunun elektron dizilimi 2p küresel simetrik elekt-
4
ron dizilimi ile sonlanırken oksijen atomunun elektron dizilimi 2p küre-
sel simetrik olmayan elektron dizilimi ile sonlanmasıdır.
Örnek
N, O ve Mg atomlarının birinci iyonlaşma enerjilerini karşılaştırınız.
7 8 12
Çözüm
3
2
2
N: 1s 2s 2p 2. periyot 5A grubu
7
4
2
O: 1s 2s 2p 2. periyot 6A grubu
2
8
2
6
2
2
Mg: 1s 2s 2p 3s 3. periyot 2A grubu
12
Aynı periyotta iyonlaşma enerjisi 5A > 6A’dır. Gruplarda yukarıdan aşağıya doğru inildikçe iyonlaşma
enerjisi azalır. Buna göre verilen elementlerin birinci iyonlaşma enerjileri N > O > Mg şeklindedir.
49
KİMYA 11. SINIF