Page 13 - Fen Lisesi Kimya 9 | 2. Ünite
P. 13
ATOM VE PERİYODİK SİSTEM
Bu ışınlara katot ışınları denir. Katot ışınlarının daha sonra (−) yüklü BİLGİ KUTUSU
elektronlar olduğu anlaşılmıştır. 1891’de George Johnstone Stoney (Corc
Conston Stoney) bu (−) yüklü taneciklere “elektron” adının verilmesini
önermiştir. 1 akb:1 tane C-12 izotopu-
J. J. Thomson (Tamsın) yapmış olduğu çalışmalar sonucunda; atom- nun kütlesinin 1/12’sidir.
daki (−) yük kadar (+) yük olduğunu ve bu yüklerin atomda homojen da-
ğıldığını belirtmiştir. Ernest Rutherford yaptığı alfa (α) tanecikleri saçılma
deneyi ile (+) yüklü taneciklerin atomun çekirdeğinde (merkezinde) top-
landığı ve bu (+) yüklerin çekirdeğin kütlesinin yaklaşık yarısına eşit oldu-
ğu sonucuna varmıştır. Daha sonra, James Chadwick (Ceymis Çedvik)
1932 yılında nötronu keşfetmiştir.
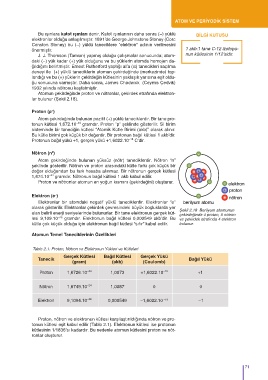
Atomun çekirdeğinde proton ve nötronlar, çekirdek etrafında elektron-
lar bulunur (Şekil 2.18).
Proton (p )
+
Atom çekirdeğinde bulunan pozitif (+) yüklü taneciklerdir. Bir tane pro-
−24
tonun kütlesi 1,672.10 gramdır. Proton “p” şeklinde gösterilir. SI birim
sisteminde bir taneciğin kütlesi “Atomik Kütle Birimi (akb)” olarak alınır.
Bu kütle birimi çok küçük bir değerdir. Bir protonun bağıl kütlesi 1 akb’dir.
−19
Protonun bağıl yükü +1, gerçek yükü +1,6022.10 C’dir.
0
Nötron (n )
Atom çekirdeğinde bulunan yüksüz (nötr) taneciklerdir. Nötron “n”
şeklinde gösterilir. Nötron ve proton arasındaki kütle farkı çok küçük bir
değer olduğundan bu fark hesaba alınmaz. Bir nötronun gerçek kütlesi
−24
1,674.10 gramdır. Nötronun bağıl kütlesi 1 akb kabul edilir.
Proton ve nötronlar atomun en yoğun kısmını (çekirdeğini) oluşturur.
Elektron (e )
−
Elektronlar bir atomdaki negatif yüklü taneciklerdir. Elektronlar “e”
olarak gösterilir. Elektronlar çekirdek çevresindeki büyük boşluklarda yer
Şekil 2.18 Berilyum atomunun
alan belirli enerji seviyelerinde bulunurlar. Bir tane elektronun gerçek küt-
çekirdeğinde 4 proton, 5 nötron
−28
lesi 9,109.10 gramdır. Elektronun bağıl kütlesi 0,000549 akb’dir. Bu ve çekirdek etrafında 4 elektron
kütle çok küçük olduğu için elektronun bağıl kütlesi “sıfır” kabul edilir. bulunur.
Atomun Temel Taneciklerinin Özellikleri
Tablo 2.1: Proton, Nötron ve Elektronun Yükleri ve Kütleleri
Gerçek Kütlesi Bağıl Kütlesi Gerçek Yükü
Tanecik Bağıl Yükü
(gram) (akb) (Coulomb)
Proton 1,6726.10 −24 1,0073 +1,6022.10 −19 +1
Nötron 1,6749.10 −24 1,0087 0 0
Elektron 9,1094.10 −28 0,000549 −1,6022.10 −19 −1
Proton, nötron ve elektronun kütlesi karşılaştırıldığında nötron ve pro-
tonun kütlesi eşit kabul edilir (Tablo 2.1). Elektronun kütlesi ise protonun
kütlesinin 1/1836’sı kadardır. Bu nedenle atomun kütlesini proton ve nöt-
ronlar oluşturur.
70 71