Page 37 - Kimya 11 | 1.Ünite
P. 37
Modern Atom Teorisi
Oluşan hidroksit bileşiği suda ne kadar çok iyonlaşıyorsa bileşiğin
bazik özelliği o kadar büyük olur. Periyodik tabloda aynı grupta yu-
karıdan aşağıya doğru inildikçe metal atomunun çapı artar. Metalle
-
OH iyonunun etkileşiminin şiddeti azalır. Böylece metal hidroksit suda
daha çok iyonlaşır. Bu nedenle aynı grupta yukarıdan aşağıya doğru
inildikçe hidroksit bileşiklerinin bazlık karakteri artar.
Ametal oksitlerinin genellikle oksijence zengin olanlarına (ametal
atomu sayısından daha fazla oksijen atomu içeren CO , N O vb.) asi-
2 5
2
+
dik oksit denir. Asidik oksitlerin su ile tepkimelerinde H iyonu oluştu-
ğu için sulu çözeltileri asidik özellik gösterir. 7A grubu elementlerinin
oluşturduğu HF, HCl, HBr, HI bileşikleri de asittir. Grupta aşağıya doğ-
ru inildikçe atom yarıçapı arttığından ametalle hidrojen arasındaki ko-
valent bağın gücü azalır ve HI suda daha çok iyonlaşır. Bu nedenle asit-
lik kuvvetleri
HF < HCl < HBr < HI şeklindedir.
Ametal oksitlerinin genellikle oksijence fakir olanlarına (ametal
atomu sayısına eşit veya daha az oksijen atomu içeren CO, NO, N O
2
vb.) nötr oksit de denir.
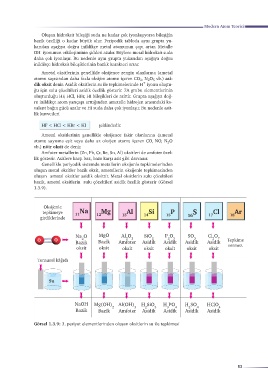
Amfoter metallerin (Zn, Pb, Cr, Be, Sn, Al) oksitleri de amfoter özel-
lik gösterir. Asitlere karşı baz, baza karşı asit gibi davranır.
Genellikle periyodik sistemde metallerin oksijenle tepkimelerinden
oluşan metal oksitler bazik oksit, ametallerin oksijenle tepkimesinden
oluşan ametal oksitler asidik oksittir. Metal oksitlerin sulu çözeltileri
bazik, ametal oksitlerin sulu çözeltileri asidik özellik gösterir (Görsel
1.3.9).
Oksijenle
tepkimeye
girdiklerinde
Na O MgO Al O 3 SiO 2 P O 5 SO 3 Cl O 7
2
2
2
O O 2 Tepkime
Bazik Bazik Amfoter Asidik Asidik Asidik Asidik
oksit oksit oksit oksit oksit oksit oksit vermez.
Turnusol kâğıdı
Su
NaOH Mg(OH) Al(OH) H SiO H PO H SO HClO
2 3 2 3 3 4 2 4 4
Bazik Bazik Amfoter Asidik Asidik Asidik Asidik
Görsel 1.3.9: 3. periyot elementlerinden oluşan oksitlerin su ile tepkimesi
53