Page 32 - Kimya 11 | 1.Ünite
P. 32
Modern Atom Teorisi
vardır. İyonlaşma enerjisi genellikle bir mol atomdan bir mol elektron
uzaklaştırmak için gereken enerjidir. Bu enerjinin birimi kj/mol cinsin-
den ifade edilir.
Nötr bir atomdan art arda elektron uzaklaştırılması işleminde ilk
elektronun uzaklaştırılması için gereken enerji diğer iyonlaşma ener-
jilerinden her zaman küçüktür. Örneğin 1. iyonlaşma enerjisi 2. iyon-
laşma enerjisinden, 2. iyonlaşma enerjisi ise 3. iyonlaşma enerjisinden
küçüktür. Her ardışık elektron daha fazla iyonlaşma enerjisi gerektirir.
İ.E < İ.E < İ.E < İ.E <...
2
3
4
1
Bunun nedeni uzaklaştırılan her elektrondan sonra kalan elektron başı-
na düşen çekim gücünün daha fazla olmasıdır.
Genel olarak iyonlaşma enerjisi ile atom yarıçapı ters orantılıdır.
Atomun yarıçapı arttıkça (elektron çekirdekten uzaklaştığı için) iyon-
laşma enerjisi küçülür. İyonlaşma enerjisinin büyüklüğü çekirdeğin
elektronu ne kadar güçlü çektiğinin bir ölçüsüdür. İyonlaşma enerjisi
büyükse elektronu atomdan uzaklaştırmak son derece zordur. Başka bir
deyişle iyonlaşma enerjisi atom yarıçapının bir fonksiyonudur ve yarı-
çap ne kadar büyük olursa elektronun en dıştaki katmandan koparılma-
sı için gereken enerji miktarı da o kadar az olur.
Periyodik sistemde aynı grupta yukarıdan aşağıya doğru inildikçe
atom yarıçapı artarken iyonlaşma enerjisi azalır. Örneğin aynı grupta
bulunan Be ve Mg elementlerinin 1. iyonlaşma enerjileri karşılaştırıl-
dığında Mg’un atom çapı Be'dan büyük olduğu için iyonlaşma enerjisi
daha küçüktür. Be'un son katmandaki elektronlar çekirdeğe daha yakın
olduğu için çekirdek tarafından daha sıkı tutulur.
2 katman = 2. periyot 3 katman = 3. periyot
Be Mg
4 12
- - 2e - 8e - 2e -
1. iyonlaşma enerjisi 2e 2e
-1
(kj mol ) Son katmandaki = 2A Grubu 2e = 2A Grubu
-
elektron sayısı
1.
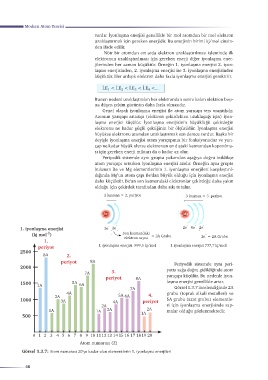
periyot I. iyonlaşma enerjisi 899,5 kj/mol I. iyonlaşma enerjisi 737,7 kj/mol
2500
8A 2.
periyot 8A Periyodik sistemde aynı peri-
2000 yotta sağa doğru gidildiğinde atom
7A 3.
periyot 8A yarıçapı küçülür. Bu nedenle iyon-
1500 5A laşma enerjisi genellikle artar.
1A 6A
7A Görsel 1.3.7 incelendiğinde 2A
4A grubu (toprak alkali metalleri) ve
2A 5A 6A 4.
1000 3A 4A periyot 5A grubu (azot grubu) elementle-
2A ri için iyonlaşma enerjisinde sap-
1A 1A 3A 2A malar olduğu gözlenmektedir.
500 1A
0 1 2 3 4 5 6 7 8 9 10 1112 13 14 15 16 17 1819 20
Atom numarası (Z)
Görsel 1.3.7: Atom numarası 20’ye kadar olan elementlerin 1. iyonlaşma enerjileri
48