Page 11 - Kimya 11 | 6.Ünite
P. 11
Kimyasal Tepkimelerde Denge
Denge Sabiti Hesaplamaları
ÖRNEK VE ÇÖZÜM
Örnek Çözüm
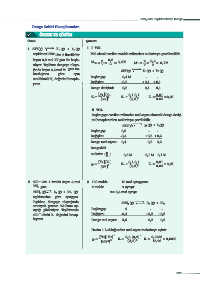
1. 2XY(g) X (g) + Y (g) 1. I. YOL
2
2
o
tepkimesi 250 C’ta 2 litrelik bir Mol olarak verilen madde miktarları molariteye çevrilmelidir.
kapta 0,8 mol XY gazı ile başla- n , 08 n , 02
, M
MXY = = = 04 MY2 = = = 01
, M
tılıyor. Tepkime dengeye ulaştı- V 2 V 2
ğında kapta 0,2 mol Y gazı bu- 2XY(g) X (g) + Y (g)
2
2
2
lunduğuna göre aynı
Başlangıç: 0,4 M - -
sıcaklıktaki K değerini hesapla- Değişim: -0,2 +0,1 +0,1
c
yınız.
Denge derişimi: 0,2 0,1 0,1
,. ,01
6 Y2 6 @ X2@ 01 , 001
Kc= 2 Kc= 2 Kc= = , 025
6 XY@ ^ , 02h , 004
II. YOL
Başlangıçta verilen miktarlar mol sayısı alınarak denge derişi-
mi hesaplanırken molariteye çevrilebilir.
2XY(g) X (g) + Y (g)
2
2
Başlangıç: 0,8 - -
Değişim: -0,4 +0,2 +0,2
Denge mol sayısı: 0,4 0,2 0,2
Dengedeki
n
molarite ` j 0,2 M 0,1 M 0,1 M
V
6 Y2 6 @ X2@ 01 , 001
,. ,01
Kc= 2 Kc= 2 Kc= = , 025
6 XY@ ^ , 02h , 004
o
2. 450 C’ta 1 litrelik kapta 4 mol 2. 100 molde 10 mol ayrışıyorsa
NH gazı 4 molde x ayrışır
3
2NH (g) N (g) + 3H (g) x= 0,4 mol ayrışır.
2
2
3
tepkimesine göre ayrışıyor.
Tepkime dengeye ulaştığında
2NH (g) N (g) + 3H 2
3
2
amonyak gazının %10'nun ay-
Başlangıç: 4 - -
rıştığı gözleniyor. Tepkimenin
o
450 C’taki K değerini hesap- Değişim: -0,4 +0,2 +0,6
c
layınız. Denge mol sayısı: 3,6 0,2 0,6
Hacim 1 L olduğundan mol sayısı molariteye eşittir.
3 3
6 N2 6 @ H2@ 02 , 00432
,.(, )06
Kc= 2 Kc= 2 Kc= = , 0 0033
6 NH3@ ^ , 36h 12 ,96
229