Page 27 - Kimya 11 | 6.Ünite
P. 27
Kimyasal Tepkimelerde Denge
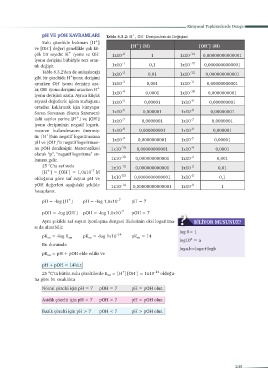
pH VE pOH KAVRAMLARI Tablo 6.3.2: H , OH Derişimlerinin Değişimi
-
+
+
Sulu çözeltide bulunan [H ] + -
- [H ] (M) [OH ] (M)
ve [OH ] değeri genellikle çok kü-
+ -
çük bir sayıdır. H iyonu ve OH 1x10 -0 1 1x10 -14 0,00000000000001
iyonu derişimi birbiriyle ters oran- -1 -13
tılı değişir. 1x10 0,1 1x10 0,0000000000001
Tablo 6.3.2’den de anlaşılacağı 1x10 -2 0,01 1x10 -12 0,000000000001
+
gibi bir çözeltide H iyonu derişimi
- -3 -11
artarken OH iyonu derişimi aza- 1x10 0,001 1x10 0,00000000001
- +
lır, OH iyonu derişimi artarken H -4 -10
1x10 0,0001 1x10 0,0000000001
iyonu derişimi azalır. Ayrıca küçük
sayısal değerlerle işlem zorluğunu 1x10 -5 0,00001 1x10 -9 0,000000001
ortadan kaldırmak için kimyager -6 -8
Soren Sorensen (Saren Sarensen) 1x10 0,000001 1x10 0,00000001
+ -
üslü sayılar yerine [H ] ve [OH ] -7 -7
1x10 0,0000001 1x10 0,0000001
iyonu derişiminin negatif logarit-
masının kullanılmasını önermiş- 1x10 -8 0,000000001 1x10 -6 0,000001
+
tir. [H ]'nin negatif logaritmasına -9 -5
- 1x10 0,0000000001 1x10 0,00001
pH ve [OH ]'in negatif logaritması-
na pOH denilmiştir. Matematiksel 1x10 -10 0,00000000001 1x10 -4 0,0001
olarak “pˮ, “negatif logaritmaˮ an-
1x10 -11 0,000000000001 1x10 -3 0,001
lamına gelir.
25 °C'ta saf suda 1x10 -12 0,000000000001 1x10 -2 0,01
+ - -7
[H ] = [OH ] = 1,0x10 M
-13 -1
olduğuna göre saf suyun pH ve 1x10 0,0000000000001 1x10 0,1
pOH değerleri aşağıdaki şekilde 1x10 -14 0,00000000000001 1x10 -0 1
hesaplanır.
+
-7
pH = -log [H ] pH = -log 1,0x10 pH = 7
- -7
pOH = -log [OH ] pOH = -log 1,0x10 pOH = 7
Aynı şekilde saf suyun iyonlaşma dengesi ifadesinin eksi logaritma- BİLİYOR MUSUNUZ?
sı da alınabilir.
log 0= 1
pK = -log K pK = -log 1x10 -14 pK = 14
su
su
su
su
a
log10 = a
Bu durumda
loga.b=loga+logb
pK = pH + pOH elde edilir ve
su
pH + pOH = 14’tür.
o
-
+
25 C’ta bütün sulu çözeltilerde K = [H ][OH ] = 1x10 -14 olduğu-
su
na göre bu sıcaklıkta
Nötral çözelti için pH = 7 pOH = 7 pH = pOH olur.
Asidik çözelti için pH < 7 pOH > 7 pH < pOH olur.
Bazik çözelti için pH > 7 pOH < 7 pH > pOH olur.
245