Page 29 - Kimya 11 | 6.Ünite
P. 29
Kimyasal Tepkimelerde Denge
ÇÖZEREK ÖĞRENİN
1. 400 mL hacmindeki HCl çözel-
tisinin pH değeri 2 olduğuna
göre çözeltide kaç mol HCl çö-
zündüğünü bulunuz.
2. pH değeri 6 olan sabunlu su-
-
daki OH iyonu derişimini bu-
lunuz.
NELER KAZANILACAK? Brönsted-Lowry asitleri/bazları karşılaştırılacaktır.
HATIRLAYINIZ
6.3.2. BRÖNSTED-LOWRY ASİT/BAZLARI
Asit ve bazların ilk bilimsel
Arrhenius tanımı sadece sulu çözeltilerde uygulandığı ve bazı mad- tanımlamasını Arrhenius (Arhe-
delerin asit ve bazlığını açıklamada yetersiz kaldığı için daha kapsamlı nus) yapmıştır. Bu tanıma göre
+
bir tanıma ihtiyaç duyulmuştur. su ortamında hidronyum [H O
3
Birbirinden bağımsız olarak çalışan Danimarkalı J. Brönsted (J. (veya H )] iyonu veren madde-
+
Brönşted) ve İngiliz T. Lowry (T. Lavri) tarafından yapılan daha geniş ler asit, su ortamında hidroksit
kapsamlı asit ve baz tanımı 1923 yılında kabul görmüştür. Bu tanıma (OH ) iyonu veren maddeler ise
-
+
+
göre proton (H ) veren maddeler asit, proton (H ) alan maddeler baz- bazdır. Arrhenius tanımı yapısın-
dır ve asit-baz tepkimelerinde proton, asitten baza aktarılır. Örneğin da hidrojen içeren HCl, HNO ,
3
-
+
HI(g) + H O(s) H O (suda) + I (suda) tepkimesinde HI, H CO , H SO , H PO gibi bile-
3
2
2
3
3
4
4
2
H O’ya proton verdiği için asit, H O ise proton aldığı için bazdır (Görsel şiklerin asitliğini ve yapısında
2
2
6.3.3). hidroksit bulunan NaOH, KOH,
Mg(OH) , Al(OH) gibi bileşik-
2
3
H + lerin bazlığını açıklayabilmiştir.
+
Ancak yapısında H bulun-
mayan SO , CO , N O gibi
2
2 5
2
bileşiklerin asitliğini ve yapısın-
-
da OH bulunmayan CaO, MgO,
NH gibi bileşiklerin bazlığını
+ 3
H
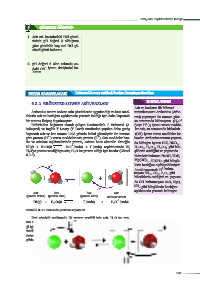
asit baz baz asit açıklamada yetersiz kalmıştır.
(proton verici) (proton alıcı) (proton alıcı) (proton verici)
-
+
HI(g) + H O(s) I (suda) + H O (suda)
2
3
Görsel 6.3.3: HIʼün suda çözünme tepkimesi
İleri yöndeki tepkimede HI proton verdiği için asit, H O ise pro-
2
+
ton aldığı için bazdır. Geri yöndeki tepkimede ise H O proton verdi-
3
-
ği için asit, I proton aldığı için bazdır. Tepkime sonucunda asit proton
verdiğinde baza dönüşürken baz da proton aldığında aside dönüşür.
Brönsted-Lowry tanımına göre aralarında bir proton farkı olan asit-baz
-
+
çiftine (HI-I ve H O -H O gibi) eşlenik (konjuge) asit-baz çifti denir.
3
2
247