Page 29 - Kimya 12 | 1.Ünite
P. 29
3. BÖLÜM: ELEKTROT POTANSIYELLERI
] 8. Alıştırma
Aşağıda standart indirgenme potansiyeli verilen elementlerin
aktifliklerini sıralayınız.
–
)
I. Ni 2+ (suda + 2e Ni(k) E o ind . = -0,250 V
–
)
II. K + (suda + 1e K(k) E o ind . = -2,931 V
–
)
III. Cu 2+ (suda + 2e Cu(k) E o ind . = 0,337 V
–
IV. H2 + (suda + 2e H (g) E o = 0,00 V
)
2 ind .
Cevap
Standart elektrot potansiyeli (gerilimi, voltajı) yardımıyla,
• Metallerin aktiflikleri,
• Metallerde aşınma olup olmayacağı,
• Metallerin asitler ile tepkime verip vermeyeceği, tepkime veriyor-
sa H gazı oluşup oluşmayacağı,
2
• Verilen bir tepkimenin istemli olup olmadığı yorumlanabilir.
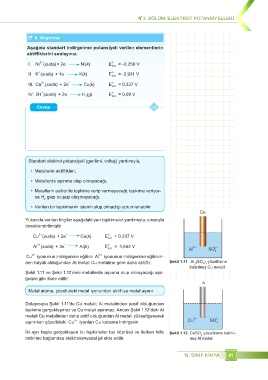
Cu
Yukarıda verilen bilgiler aşağıdaki yarı tepkimeler yardımıyla, sırasıyla
örneklendirilmiştir.
–
Cu 2+ (suda + 2e Cu(k) E o ind . = 0,337 V
)
–
Al 3+ (suda + 3e Al(k) E o ind . = -1,662 V Al 3+ SO 2–
)
4
3+
Cu iyonunun indirgenme eğilimi Al iyonunun indirgenme eğilimin-
2+
den büyük olduğundan Al metali Cu metaline göre daha aktiftir. Şekil 1.11: Al (SO ) çözeltisine
2
4 3
batırılmış Cu metali
Şekil 1.11 ve Şekil 1.12’deki metallerde aşınma olup olmayacağı aşa-
ğıdaki gibi ifade edilir:
Al
Metal atomu, çözeltideki metal iyonundan aktif ise metal aşınır.
Dolayısıyla Şekil 1.11’de Cu metali; Al metalinden pasif olduğundan
tepkime gerçekleşmez ve Cu metali aşınmaz. Ancak Şekil 1.12’deki Al
metali Cu metalinden daha aktif olduğundan Al metali yükseltgenerek 2+ 2–
aşınırken çözeltideki Cu iyonları Cu katısına indirgenir. Cu SO 4
2+
Iki ayrı kapta gerçekleşen bu tepkimeler tuz köprüsü ve iletken telle Şekil 1.12: CuSO çözeltisine batırıl-
4
birbirine bağlanırsa elektrokimyasal pil elde edilir. mış Al metali
12. SINIF KIMYA 41