Page 8 - Fen Lisesi Kimya 10 | 3. Ünite
P. 8
pH, hidrojen iyonu derişimine, pOH ise hidroksil iyonu derişimine göre
belirlenir (Görsel 3.5).
pH ve pOH 0-14 sayı aralığında ifade edilir.
pH 0 7 14
Asitlik artar. Nötr Bazlık artar.
pOH 0 7 14
Bazlık artar. Nötr Asitlik artar.
o
25 C’de bir çözeltide pH + pOH = 14 alınır.
25 C’de bir sulu çözeltide
o
+
[H ] > [OH¯] ise pH < 7, pOH > 7’dir ve çözelti asidiktir.
+
[H ] = [OH¯] ise pH = pOH = 7’dir ve çözelti nötrdür.
+
[H ] < [OH¯] ise pH > 7, pOH < 7’dir ve çözelti baziktir.
+
HCl çözeltisinde H derişimi OH¯ derişiminden büyük olup pH değeri
+
7’den küçüktür. NaOH çözeltisinde ise H derişimi OH¯ derişiminden kü-
Görsel 3.5: Sulu çözeltilerde pH
+
değerleri çük olup pH değeri 7’den büyüktür. Bir asit çözeltisine baz eklenirse H
derişimi azalırken OH¯ derişimi ve pH değeri artar. Bir baz çözeltisine asit
+
eklenirse H derişimi artar OH¯ derişimi ve pH değeri azalır.
BİLGİ KUTUSU
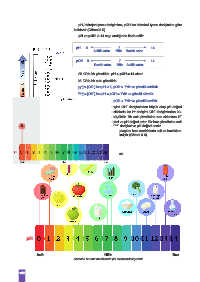
Aşağıda günlük hayatta karşılaşılan bazı maddelerin asit ve bazlıkları-
nın pH skalasındaki yerleri verilmiştir (Görsel 3.6).
Bir çözeltinin asitlik ya da baz-
lık derecesini ifade eden pH'nin
açılımı power of hydrogen’dir
(hidrojenin potansiyeli).
pH skalası
pH
Asit Nötr Baz
Görsel 3.6: Bazı maddelerin pH skalasındaki yerleri
128 129