Page 261 - Kimya 9 Beceri Temelli Etkinlik Kitabı
P. 261
KİMYA 9 Ortaöğretim Genel Müdürlüğü
CEVAP ANAHTARLARI
Etkinlik No.: 39
1. Yönerge
1. IA IIA IIIA IVA VA VIA VIIA VIIIA
Değerlik
Elektron 1 2 3 4 5 6 7 8
Sayısı
2.
3. IA VIIIA
H – IIA IIIA IVA VA VIA VIIA He
Li + Geçiş Metalleri N 3– O 2– F – Ne
Na + Mg 2+ Al 3+ S 2– Cl – Ar
K + Ca 2+
2. Yönerge
1. Bir atomun elektron konfigürasyonu bir element atomunun Etkinlik No.: 40
kimyasal davranışını belirler, ancak bir atomun tepkime verip 1. Aşama
vermeyeceğini ve ne tür bir kimyasal tepkime vereceğini belirle-
mek için en dış katmanda yer alan değerlik elektronlarına bakı- Element:
lır. En dıştaki elektronlar, kimyasal reaksiyona girer. Lewis yapı-
ları, yalnızca en dıştaki elektronları göstermenin kısa yolu olup
kimyasal reaksiyonları ifade etme yönteminde kolaylık sağlar.
VIIIA grubunda yer alan element atomları sahip olduğu elektron 11P + 9P +
düzeni nedeniyle en düşük enerjili hâldedirler ve bu hâli koru- 12n 2 8 1 10n 2 7
ma eğilimindedirler. Bu nedenle kimyasal bağ yapmazlar. Diğer
elementlerde VIIIA grubu element atomları gibi en düşük ener- Katman elektron dizilimi:
jili hâle ulaşabilmek için değerlik elektronlarını helyuma (He)
benzemek için 2’ye (dublet), neon (ne) ve argona (Ar) benzemek Lewis yapısı:
için 8’e tamamlamaya çalışırlar. Bunun için kimyasal bağ yapma
eğilimindedirler.
Örneğin IA grubunda yer alan sodyum (Na), potasyum (K) ve 2. Aşama
lityumun (Li) her birinin en dış kabuklarında tek bir elektron Atomlar iyonik bileşik oluştururken soy gaz elektron dizilimine
vardır. Üç atom benzer şekilde reaksiyona girer. İyonik bağ olu- benzemek için değerlik elektronu adı verilen son katmanların-
şumu sırasında bir elektronunu kaybederek “+“ yüklü iyon hâli- daki elektronları alır veya verir. Na soy gaz elektron dizilimine
ne geçerler. VIIA grubunda yer alan flor (F) ve klor (Cl) atomları benzemek için bir elektron vererek +1 yüklü iyon oluşturur. F
her birinin en dış kabuklarında 7elektron vardır. İki atom benzer soy gaz elektron dizilimine benzemek için bir elektron alır. -1
şekilde reaksiyona girer. İyonik bağ oluşumu sırasında bir elekt- yüklü iyon oluşturur. Zıt yüklü iyonların güçlü etkileşimleri so-
ronunu kazanarak “ - ” yüklü iyon hâline gelir. IA ve VIIA grup nucu NaF iyonik bileşiği oluşur.
elementlerinin son katman elektron yapısı, aralarında iyonik bağ
oluşabileceğini gösterir. 3. Aşama
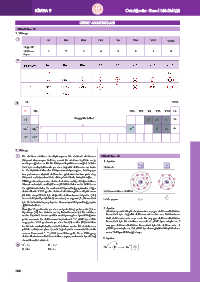
2. Li : 0 e - F- : 8 e- + -
+
C : 8 e- Cl : 8 e- Na + F Na F
260