Page 264 - Kimya 9 Beceri Temelli Etkinlik Kitabı
P. 264
Ortaöğretim Genel Müdürlüğü KİMYA 9
CEVAP ANAHTARLARI
4. Lewis nokta yapısında, atomun sahip olduğu her bir değerlik 4. Tabloya göre ortak özellik periyot numarası arttıkça molekülle-
elektronu bir nokta ile gösterilir. Bir molekülü/bileşiği oluştur- rin toplam elektron sayısının düzenli olarak artmasıdır. Elektron
mak için bir araya gelen element atomlarının değerlik elektron- sayısı arttıkça genel eğilime göre beklenen kaynama noktalarının
ları kimyasal bağ oluşumunda etkindir. Kimyasal bağ yapmadan da artmasıdır. 2. periyotta yer alan moleküller kaynama noktası
önce ve kimyasal bağ yaptıktan sonra tüm element atomlarının bakımından bu eğilime uymamaktadır. Bunun nedeni 2. peri-
sahip olduğu değerlik elektronlarının toplam sayısı değişmez. yottaki moleküler bileşiklerin hidrojen bağı yapmasıdır.
Bu da oluşan bileşik/molekülde kimyasal bağların oluşum 5. Molekülü oluşturan atomların elektronegativitesi, moleküldeki
şeklini (elektron ortaklığı ya da alışverişi sonucu olup olma- elektron sayısı ve molekül boyutu farklılaşmanın nedenidir.
dığını) daha kolay incelememizi ve ifade etmemizi sağlar.
NH 3 , H 2 O ve HF molekülleri dipol-dipol etkileşimin özel bir
Örneğin NaCl bileşiğinde, durumu olan hidrojen bağı yapar. Hidrojen bağının dipol-dipol
etkileşimlerden farklı olmasının nedeni,
• H ile elektronegatif F, O ve N atomları arasındaki oluşan bü-
yük elektronegativite farkı nedeniyle daha güçlü bir çekim
gerçekleşmesi,
• İyonik bağlı NaCl bileşiği oluşmadan önce Na atomu 1 de • Hidrojen bağı yapan molekül atomlarının küçük boyutları
F
N
F O O N
ğerlik elektronuna Na , Cl atomu 7 değerlik elektronuna Cl nedeniyle birbirlerine daha çok yaklaşabilmeleridir.
sahiptir. Değerlik elektronları toplam sayısı 8’ dir.
• Bağ yapmak üzere yaklaştıklarında Cl atomu, sodyum (Na) 6.
+
atomundan 1 değerlik alır ve böylece bir elektron kazanır.
-
+ 2
-
-
Cl
F
F Mg
Na
Bunun sonucunda sodyumun (Na) değerlik elektronu kal-
+
maz ve Na iyonu oluşur, klor atomu (Cl) bir elektron aldığı
için değerlik orbitalinde artık 8 elektron vardır. Cl- iyonu
+
-
+ 2
-
-
Br
K
oluşur. Bu iyonların birbirini çekmesi ile oluşan bileşikte
Cl Ca
Cl
elektronlar sabit kalır. Bileşikte toplam değerlik elektronları
sayısı 8’ dir.
Örneğin CH 4 bileşiğinde, H
Cl
Cl C Cl H N H H C H
Cl H H
• Kovalent bağlı NH 3 bileşiği oluşmadan önce her bir hidrojen
-
+
(H) atomu 1 değerlik elektronuna H , azot (N) atomu 5 de-
F
ğerlik elektronuna N sahiptir. Değerlik elektronları toplam Etkinlik No.: 51
sayısı 8’dir.
Cl
• Her atom kendi değerlik elektronunu kaybetmeksizin diğer 1. NH 3 , HCl , H 2 O , CH 4 , BH 3 , CO 2
Cl C
Cl
atomla ortak kullandığından bileşikte sayı yine aynıdır. 2. O 2 , N 2 , H 2
Cl
3. Polar: NH 3 , HCl , H 2 O Apolar: O 2 , N 2 , CH 4 , BH 3 , CO 2
Etkinlik No.: 50
4. CH 4 , BH 3 , CO 2
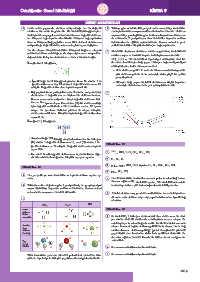
1. Her periyotta yer olan moleküllerin toplam elektron sayıları ay-
nıdır. 5. Her iki molekülde de atomlar arasında polar kovalent bağ bulun-
masına rağmen BH 3 molekülü apolar, NH 3 molekülünde ortak-
2. Tabloda verilen değerlere göre 2. periyot hariç her grupta periyot lanmamış elektron çifti bulunduğundan molekül polardır.
sayısı büyüdükçe kaynama noktası artmaktadır. Bunun nedeni
artan elektron sayısı ve molekül kütlesidir. 6. Ametal atomları soy gaz elektron dizilimine benzemek için ken-
di aralarında elektron alışverişi yapamadıklarından iyonik bağ
3. oluşmaz.
NH 3 H O HCl
2
Lewis Etkinlik No.: 52
Elektron
Nokta 1. Su molekülü, 2 hidrojen atomundaki birer elektronun bir oksi-
Formülleri
jen atomundaki iki elektronla ortaklaşması sonucu oluşur. Bu
ortaklaşmaya kovalent bağ adı verilir. Farklı iki ametal arasında
Atomlar
Arası H N H O oluşan kovalent bağda elektronegatiflik farkı oluşur. Bu da bağ
Elektron H elektronlarının, elektronegatifliği (şirket örneğindeki yüzdelik
Ortaklığı H H pay) büyük olan tarafından daha fazla çekilmesi demektir. Bu
δ - δ - duruma rağmen molekül kararlı bir bütün olarak varlığını de-
Top δ + δ - vam ettirir.
Çubuk
Modeli + δ + 2. Sorunun cevabı öğrenciye bırakılmıştır.
δ +
δ + δ δ +
3. Sorunun cevabı öğrenciye bırakılmıştır.
Tüm moleküller polardır. Molekül polariteleri, moleküler bile-
şiklerin dipol-dipol etkileşim yapabileceklerini göstermektedir.
263