Page 268 - Kimya 9 Beceri Temelli Etkinlik Kitabı
P. 268
Ortaöğretim Genel Müdürlüğü KİMYA 9
CEVAP ANAHTARLARI
3. Elektron sayısı arttıkça molekülün kutuplanabilirliği artar. I 2 2.
molekülünün elektron sayısı Br 2 molekülünün elektron sayısın-
dan daha çok olduğu için oluşan geçici kutupluluk daha fazladır.
Bu yüzden I 2 molekülünün erime sıcaklığı Br 2 molekülünün eri-
me sıcaklığından daha yüksektir. Apolar moleküller arasındaki
etkileşimlerin gücü elektron sayısı ve molekül şekline bağlı ola-
rak değişir.
4. CH 3 -CH 2 -CH 3 bileşiği apolar olduğu için bu bileşikte indüklen-
miş dipol-indüklenmiş dipol etkileşimi gözlenir. Bu yüzden kay-
o
nama sıcaklığı en düşük (-42,1 C) olmalıdır. CH 3 CH 2 OH bileşi-
ği polardır ve hidrojen bağı içerir. Kaynama sıcaklığı en yüksek
o
(78,4 C) olmalı. CH 3 -O-CH 3 bileşiği polardır ve hidrojen bağı
içermez, öyleyse kaynama sıcaklığı diğer iki bileşiğin kaynama
sıcaklıkları arasında (24,8 C) olmalıdır.
o
Etkinlik No.: 69
1. Yönerge
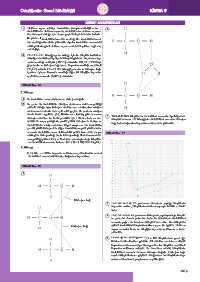
1. Su molekülleri arasında bulunan hidrojen bağıdır.
2. Su polar bir moleküldür. Oksijen atomunun elektronegatifliği
yüksek olduğu için hidrojen atomlarının elektronları oksijen
atomunun etrafında daha çok vakit geçirir. Bu nedenle oksijen
tarafı kısmi negatiftir (δ-). Elektronsuz kalmış gibi davranan
hidrojen atomları ise kısmi pozitiftir (δ+). Birden fazla su mo- 3. Tablodaki tüm bileşiklerin molekülleri arasında dipol-dipol et-
lekülü bir araya geldiğinde pozitif yüklü hidrojen ile komşu su kileşimi bulunur. HF bileşiğinin molekülleri arasında hidrojen
molekülünün oksijen atomları köprü oluşturur. Bir molekülün bağı bulunduğundan kaynama noktası daha yüksektir.
pozitif yüklü hidrojeni ile diğer molekülün negatif yüklü atomu
arasında moleküller arası elektrostatik çekim kuvveti ile oluşan Etkinlik No.: 71
etkileşime hidrojen bağı denir. Hidrojen bağı H atomunun elekt-
ronegatifliği yüksek F, O, ve N atomlarıyla oluşturduğu bileşikle-
rin molekülleri arasında bulunur (NH 3 , H 2 O, HF, CH 3 OH gibi.).
2. Yönerge
H 2 O, NH 3 ve HF’ün kaynama noktalarının yüksek olma nedeni
molekülleri arasındaki hidrojen bağından kaynaklanır.
Etkinlik No.: 70
1.
Hidrojen bağı
1. Hem 6A hem de 7A grubunun hidrojenle yaptığı bileşiklerin
kaynama noktası, bileşiklerin elektron sayısıyla birlikte artmak-
tadır.
2. Hem 6A hem de 7A grubunun hidrojenle yapmış olduğu bileşik-
ler polardır. Ancak polar da olsalar bu bileşiklerin molekülleri
arasında yoğun bir London etkileşimi mevcuttur. Bu etkileşimin
Hidrojen bağı şiddeti moleküldeki toplam elektron sayısı ile ilgilidir. Elektron
sayısı ne kadar fazla ise bileşiğin kaynama noktası da o kadar
yüksektir.
3. Grafik eğrileri çizildiğinde H 2 O ve HF bileşiklerinin genel eği-
limden farklı oldukları görülür. Ait oldukları serinin en düşük
kaynama noktasına sahip olması gereken bu bileşikler en yüksek
kaynama noktasına sahiptir. Bu durumun sebebi, bileşiklerin
molekülleri arasında bulunan hidrojen bağıdır. Hidrojen bağı,
zayıf etkileşimlerin en güçlüsü olduğundan bu bileşiklerin kay-
nama noktası kendi gruplarının en yükseğidir.
267