Page 61 - Fen Lisesi Biyoloji 11 | 1.Ünite
P. 61
Bölüm 5 Solunum Sistemi
1.5.3. Solunum Gazlarının Taşınması
İnsanda solunum gazları, kandaki alyuvarda bulunan solunum pig-
menti olan hemoglobin yardımıyla taşınır. Bir alyuvar yaklaşık 250 mil-
yon hemoglobin molekülü içerir. Bu pigment, kanın oksijen taşıma ka-
pasitesini arttırır ve solunum gazları ile tersinir (çift yönlü tepkime) bir
şekilde bileşik oluşturur. Oksijenin alyuvarlarda hemoglobin pigmenti
ile taşınma miktarı, kanın plazma kısmında çözünmüş olarak taşınan
oksijen miktarından 30 ile 100 kat daha fazladır. Vücudun doku hüc-
relerinde hücresel solunum tepkimeleriyle kullanımı sonucu karbondi-
oksit açığa çıkar. Karbondioksitin doku hücrelerinden uzaklaştırılması
da hemoglobin pigmenti yardımıyla gerçekleşir. Alyuvarların yapısında
Bilgi Notu
bulunan protein yapılı hemoglobin molekülü, merkezinde bir demir
atomu taşıyan hem adlı kofaktöre sahip dört alt birimden ve globü- Kofaktör: Bir enzimin aktifliği için
lin proteininden oluşmuştur. Hem grubu kana kırmızı rengini verir. Her gerekli olan, proteine gevşek ya da sı-
demir atomu bir molekül oksijen bağlar. Bu sayede bir hemoglobin kıca bağlı olan, bir metal iyonu (akti-
vatör) gibi protein olmayan maddedir.
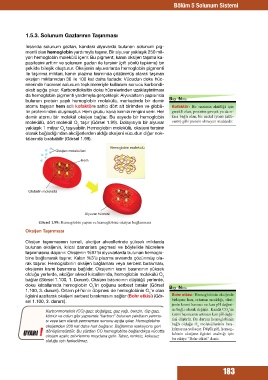
molekülü, dört molekül O taşır (Görsel 1.99). Dolayısıyla bir alyuvar
2
yaklaşık 1 milyar O taşıyabilir. Hemoglobin molekülü, oksijeni tersinir
2
olarak bağladığından akciğerlerden aldığı oksijeni vücudun diğer nok-
talarında bırakabilir (Görsel 1.99).
Hemoglobin molekülü
Oksijen molekülleri
Hem
Globülin molekülü
Alyuvar hücresi
Görsel 1.99: Hemoglobin yapısı ve hemoglobine oksijen bağlanması
Oksijen Taşınması
Oksijen taşınmasının temeli, akciğer alveollerinde yüksek miktarda
bulunan oksijenin, kılcal damarlara geçmesi ve böylelikle hücrelere
taşınmasına dayanır. Oksijenin %97’si alyuvarlarda bulunan hemoglo-
bine bağlanarak taşınır. Kalan %3’ü plazma sıvısında çözünmüş ola-
rak taşınır. Hemoglobinin oksijen bağlaması veya serbest bırakması,
oksijenin kısmi basıncına bağlıdır. Oksijenin kısmi basıncının yüksek
olduğu yerlerde, akciğer alveol kılcallarında, hemoglobin molekülü O
2
bağlar (Görsel 1.100, 1. Durum). Oksijen basıncının düştüğü yerlerde,
doku kılcallarında hemoglobin O ’in çoğunu serbest bırakır (Görsel
2 Bilgi Notu
1.100, 3. durum). Ortam pH’sinin düşmesi de hemoglobinin O ’e olan
2 Bohr etkisi: Hemoglobinin oksijenle
ilgisini azaltarak oksijeni serbest bırakmasını sağlar (Bohr etkisi) (Gör- birleşme hızı, ortamın sıcaklığı, oksi-
sel 1.100, 3. durum).
jenin kısmi basıncı ve kan pH değeri-
ne bağlı olarak değişir. Kanda CO ’in
2
Karbonmonoksit (CO) gazı; doğalgaz, gaz yağı, benzin, tüp gazı, kısmi basıncının artması kan pH değe-
kömür ve odun gibi yapısında “karbon” bulunan yakıtların yanma- rini düşürür. Bu durum hemoglobinin
sı veya tam olarak yanmaması sonucu açığa çıkar. Hemoglobine bağlı olduğu O moleküllerinin bıra-
UYARI ! oksijenden 200 kat daha hızlı bağlanır. Bağlanma reaksiyonu geri kılmasına yol açar. Düşük pH, hemog-
2
dönüşümsüzdür. Bu yüzden CO hemoglobine bağlandıkça vücutta
lobinin oksijene ilgisini azalttığı için
oksijen azalır, zehirlenme meydana gelir. Tatsız, renksiz, kokusuz bu etkiye “Bohr etkisi” denir.
olduğu için farkedilmez.
183