Page 16 - Fen Lisesi Kimya 9 | 3. Ünite
P. 16
HF’de ortaklaşa kullanılan elektronları elektronegatifliği fazla olan flor
atomu kendine daha çok çeker. Elektronlar flora daha yakın olur. Molekü-
−
lün flor ucu kısmen negatif (δ ) hidrojen ucu kısmen pozitif (δ ) olur. Bu
+
duruma elektriksel dipol (kutuplu yapı) denir. Molekülün elektriksel dipolü
sıfır olmadığından HF molekülü polar moleküldür. Üç ve daha fazla atom-
dan oluşan moleküllerde molekülün polarlığı için molekül geometrilerine
bakılır. Bu tür moleküllerde molekülün elektriksel dipolü sıfır ise molekül
apolardır. Moleküllerde elektriksel dipol varsa molekül polardır.
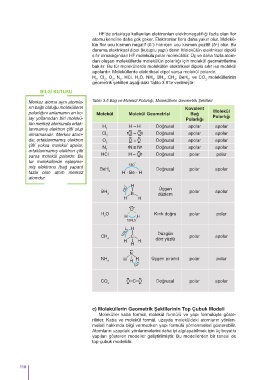
H , Cl , O , N , HCl, H O, NH , BH , CH , BeH , ve CO moleküllerinin
2 2 2 2 2 3 3 4 2 2
geometrik şekilleri aşağıdaki Tablo 3.5’te verilmiştir:
BİLGİ KUTUSU
Merkez atoma aynı atomla- Tablo 3.5 Bağ ve Molekül Polarlığı, Moleküllerin Geometrik Şekilleri
rın bağlı olduğu moleküllerin Kovalent
polarlığını anlamanın en ko- Molekül Molekül Geometrisi Bağ Molekül
lay yollarından biri molekü- Polarlığı Polarlığı
lün merkez atomunda ortak-
H H – H Doğrusal apolar apolar
lanmamış elektron çifti olup 2
olmamasıdır. Merkez atom- Cl 2 Cl – Cl Doğrusal apolar apolar
da; ortaklanmamış elektron O O = O Doğrusal apolar apolar
2
çifti yoksa molekül apolar,
=
N N N Doğrusal apolar apolar
=
ortaklanmamış elektron çifti 2
HCl H – Cl Doğrusal polar polar
varsa molekül polardır. Bu
tür moleküllerde eşleşme- ˳
180
miş elektronu (bağ yapan)
BeH Doğrusal polar apolar
fazla olan atom merkez 2 H - Be - H
atomdur.
˳
120 —H Üçgen
BH polar apolar
3 — B — düzlem
H H
O
H O — — Kırık doğru polar polar
2 H ˳ H
104,5
˳
109,5 —H Düzgün
CH — C polar apolar
4 — dört yüzlü
H — H
H
— —N —
NH H H ˳ Üçgen piramit polar polar
3 H
107
CO O=C=O Doğrusal polar apolar
2
c) Moleküllerin Geometrik Şekillerinin Top Çubuk Modeli
Moleküller kaba formül, molekül formülü ve yapı formülüyle göste-
rilirler. Kaba ve molekül formül, uzayda moleküldeki atomların yönlen-
meleri hakkında bilgi vermezken yapı formülü yönlenmeleri gösterebilir.
Atomların uzaydaki yönlenmelerini daha iyi algılayabilmek için üç boyutlu
yapıları gösteren modeller geliştirilmiştir. Bu modellerden bir tanesi de
top-çubuk modelidir.
118