Page 22 - Fen Lisesi Kimya 9 | 3. Ünite
P. 22
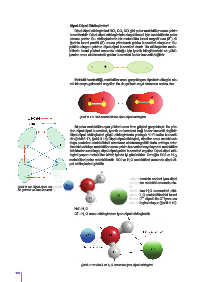
Dipol-Dipol Etkileşimleri
Dipol-dipol etkileşimleri HCl, CO, NO gibi polar moleküller arası çekim
kuvvetleridir. Dipol-dipol etkileşiminin oluşabilmesi için moleküllerin polar
−
olması şarttır. Bu etkileşimlerde bir molekülün kısmi negatif ucu (δ ) di-
+
ğerinin kısmi pozitif (δ ) ucuna yönelerek çekim kuvvetleri oluşturur. Bu
şekilde oluşan çekime dipol-dipol kuvvetleri denir. Bu etkileşimler mole-
küllerin kısmi yükleri arasında olduğu için iyonik bileşiklerdeki zıt yüklü
iyonlar arası elektrostatik çekim kuvvetleri kadar kuvvetli değildir.
- + + -
Molekül hareketliliği, moleküller arası gerçekleşen dipollerin düzgün ola-
rak bir araya gelmesini engeller. Bu da çekimin zayıf olmasına neden olur.
Şekil 3.17: HCl molekülünde dipol-dipol etkileşimi
İki polar molekülün aynı yükleri arası itme güçleri gerçekleşir. Bu yüz-
den dipol-dipol kuvvetleri, iyonik ve kovalent bağ kadar kuvvetli değildir.
Dipol-dipol etkileşimleri güçlü etkileşimlerin yaklaşık %1’i kadar kuvvetli-
dir (Şekil 3.17, Şekil 3.18).Dipol-dipol etkileşimi, dipoller arası uzaklık art-
tıkça azalırken moleküldeki atomların elektronegatiflik farkı arttıkça artar.
Sıcaklık arttıkça moleküller arası çekim kuvvetleri zayıflayarak moleküller
birbirinden uzaklaşır, dipol-dipol çekim kuvvetleri zayıflar. Dipol-dipol etki-
leşimi yapan moleküller birbiri içinde iyi çözünürler. Örneğin HCI ve H O
2
molekülleri polar moleküllerdir. HCI ve H O molekülleri arasında dipol-di-
2
pol etkileşimleri görülür.
İyon-Dipol Etkileşimi:
Bir iyonik bileşiğin polar bir molekülde çözünmesinin nedeni iyon-dipol
etkileşimidir. Bir iyon ile (katyon veya anyon) polar molekül arasında olu-
Şekil 3.18: Dipol-dipol etkileşimin- şan etkileşime iyon-dipol etkileşimi denir.
de çekme ve itme kuvvetleri İyonik bileşik olan NaCl ile polar molekül olan H O arasındaki etki-
2
−
leşim incelenirse NaCl’de Na ve Cl iyonları, H O molekülündeki kısmi
+
2 −
δ −
+
dipollerle etkileşir. Na iyonu H O molekülünün O dipolü ile Cl iyonu su
2
molekülünün H dipolü arasında iyon-dipol etkileşimi oluşur (Şekil 3.19).
δ+
+
Na - H O
2
−
Cl - H O arası etkileşimlere iyon-dipol etkileşimidir.
2
Şekil 3.19: NaCl ve H O arasında iyon-dipol etkileşimi
2
124