Page 24 - Fen Lisesi Kimya 9 | 3. Ünite
P. 24
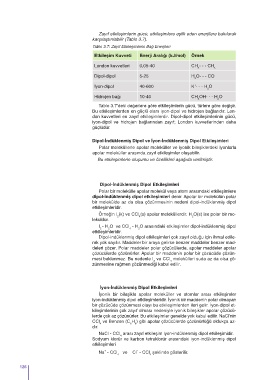
Zayıf etkileşimlerin gücü, etkileşimlere eşlik eden enerjilere bakılarak
karşılaştırılabilir (Tablo 3.7).
Tablo 3.7: Zayıf Etkileşimlerin Bağ Enerjileri
Etkileşim Kuvveti Enerji Aralığı (kJ/mol) Örnek
London kuvvetleri 0,05-40 CH - - - CH
4 4
Dipol-dipol 5-25 H O- - - CO
2
+
İyon-dipol 40-600 K - - - H O
2
Hidrojen bağı 10-40 CH OH- - - H O
3 2
Tablo 3.7’deki değerlere göre etkileşimlerin gücü, türlere göre değişir.
Bu etkileşimlerden en güçlü olanı iyon-dipol ve hidrojen bağlarıdır. Lon-
don kuvvetleri en zayıf etkileşimlerdir. Dipol-dipol etkileşimlerinin gücü,
iyon-dipol ve hidrojen bağlarından zayıf; London kuvvetlerinden daha
güçlüdür.
Dipol-İndüklenmiş Dipol ve İyon-İndüklenmiş Dipol Etkileşimleri
Polar moleküllerle apolar moleküller ve iyonik bileşiklerdeki iyonlarla
apolar moleküller arasında zayıf etkileşimler oluşabilir.
Bu etkileşimlerin oluşumu ve özellikleri aşağıda verilmiştir.
Dipol-İndüklenmiş Dipol Etkileşimleri
Polar bir molekülle apolar molekül veya atom arasındaki etkileşimlere
dipol-indüklenmiş dipol etkileşimleri denir. Apolar bir molekülün polar
bir molekülde az da olsa çözünmesinin nedeni dipol-indüklenmiş dipol
etkileşimleridir.
Örneğin I (k) ve CCl (s) apolar moleküllerdir. H O(s) ise polar bir mo-
2 4 2
leküldür.
I - H O ve CCl - H O arasındaki etkileşimler dipol-indüklenmiş dipol
2 2 4 2
etkileşimleridir.
Dipol-indüklenmiş dipol etkileşimleri çok zayıf olduğu için ihmal edile-
rek yok sayılır. Maddeler bir araya gelirse benzer maddeler benzer mad-
deleri çözer. Polar maddeler polar çözücülerde, apolar maddeler apolar
çözücülerde çözünürler. Apolar bir maddenin polar bir çözücüde çözün-
mesi beklenmez. Bu nedenle I ve CCl molekülleri suda az da olsa çö-
2 4
zünmesine rağmen çözünmediği kabul edilir.
İyon-İndüklenmiş Dipol Etkileşimleri
İyonik bir bileşikle apolar moleküller ve atomlar arası etkileşimler
iyon-indüklenmiş dipol etkileşimleridir. İyonik bir maddenin polar olmayan
bir çözücüde çözünmesi olayı bu etkileşimlerden ileri gelir. İyon-dipol et-
kileşimlerinin çok zayıf olması nedeniyle iyonik bileşikler apolar çözücü-
lerde çok az çözünürler. Bu etkileşimler genelde yok kabul edilir. NaCl’nin
CCl ve Benzen (C H ) gibi apolar çözücülerde çözünürlüğü oldukça az-
4 6 6
dır.
NaCl - CCl arası zayıf etkileşim iyon-indüklenmiş dipol etkileşimidir.
4
Sodyum klorür ve karbon tetraklorür arasındaki iyon-indüklenmiş dipol
etkileşimleri
+ −
Na - CCl ve Cl - CCl şeklinde gösterilir.
4 4
126