Page 67 - Fen Lisesi Kimya 11 | 6.Ünite
P. 67
KiMYASAL TEPKiMELERDE DENGE
Titrant, asit çözeltisine başlangıçta hızlı, dönüm noktasına yaklaştık-
ça damla damla eklenir. Dönüm noktası hem asit hem de bazın tüken-
diği, indikatörün renk değiştirdiği noktadır.
Dönüm noktası asit-baz indikatörünün renk değişimi ile belirlenir.
İndikatörün dönüm noktası, nötralleşmenin eşdeğerlik noktası ile ça-
kışmalıdır.
Titrasyon için hacmi ve derişimi belli bir asit ya da baz çözeltisi alınır.
Büret bu çözelti ile doldurulur. Erlene hacmi bilinen fakat derişimi bilin-
meyen asit ya da baz çözeltisi konur. Erlendeki çözeltiye asit-baz titras-
yonunu incelemek için birkaç damla indikatör ilave edilir veya pH metre
daldırılır. İndikatör renk değiştirerek çözeltinin asit ya da baz özellikte
olmasına göre nötralleşme anının gözlenmesini sağlar.
Büretin musluğu açılarak içindeki çözelti yavaş yavaş erlendeki çö-
zeltiye damlatılır ve erlen hafifçe çalkalanır. Damlatma işlemine, çözel-
tinin renginde bir değişim oluncaya ya da pH metre 7’yi gösterinceye
kadar devam edilir. Renk değişim anında büretin musluğu kapatılır.
Büretteki sarfiyat belirlendikten sonra derişimi bilinmeyen asit ya da baz
çözeltisinin derişimi M V Td = M V Td bağıntısından hesaplanır.
A A A B B B
Derişimi Bilinen Kuvvetli Asidin (HCl) Kuvvetli Bazla (NaOH)
Titrasyonu
Kuvvetli asit olan HCl ile kuvvetli baz olan NaOH arasındaki tepkime
aşağıdaki gibi ifade edilir:
HCl(suda) + NaOH(suda) → NaCl(suda) + H O(s)
2
ve bu tepkimenin net iyon denklemi
+
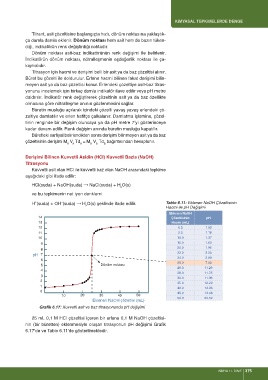
H (suda) + OH¯(suda) → H O(s) şeklinde ifade edilir. Tablo 6.11: Eklenen NaOH Çözeltisinin
2
Hacmi ile pH Değişimi
Eklenen NaOH
14 Çözeltisinin pH
13 Hacmi (mL)
12 0.0 1.00
11 5.0 1.18
10 10.0 1.37
9 15.0 1.60
20.0 1.95
8
22.0 2.20
pH 7
24.0 2.69
6
25.0 7.00
5 Dönüm noktası
26.0 11.29
4
28.0 11.75
3
30.0 11.96
2
35.0 12.22
1
40.0 12.36
0 45.0 12.46
10 20 30 40 50
50.0 22.52
Eklenen NaOH çözeltisi (mL)
Grafik 6.17: Kuvvetli asit ve baz titrasyonunda pH değişimi
25 mL 0,1 M HCl çözeltisi içeren bir erlene 0,1 M NaOH çözeltisi-
nin (bir büretten) eklenmesiyle oluşan titrasyonun pH değişimi Grafik
6.17’de ve Tablo 6.11’de gösterilmektedir.
375
KİMYA 11. SINIF