Page 23 - Kimya 11 | 5.Ünite
P. 23
Kimyasal Tepkimelerde Hız
BİLİYOR MUSUNUZ?
Eşik enerjisi ile aktivasyon
enerjisi aynı sayısal değere
sahiptir. Tek fark eşik enerjisi
kinetik enerji, aktivasyon ener-
Kinetik enerji Potansiyel enerji Ürünler
Aktivasyon enerjisi
jisi potansiyel enerjidir.
Molekül sayısı Girenler Tepkime Entalpisi
Tepkime koordinatı (zaman)
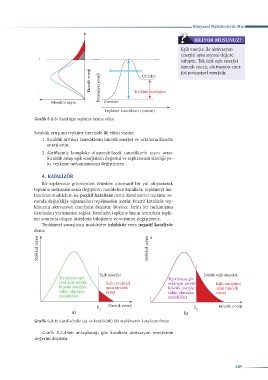
Grafik 5.2.3: Sıcaklığın tepkime hızına etkisi
Sıcaklık artışının tepkime üzerinde iki etkisi vardır:
1. Sıcaklık arttıkça taneciklerin kinetik enerjisi ve ortalama kinetik
enerji artar.
2. Aktifleşmiş kompleks oluşturabilecek taneciklerin sayısı artar.
Sıcaklık artışı eşik enerjisinin değerini ve tepkimenin izlediği yo-
lu, tepkime mekanizmasını değiştirmez.
4. KATALİZÖR
Bir tepkimede girenlerden ürünlere alternatif bir yol oluşturarak
tepkime mekanizmasını değiştiren maddelere katalizör, tepkimeyi hız-
landıran maddelere ise pozitif katalizör denir. Katalizörler tepkime so-
nunda değişikliğe uğramadan tepkimeden ayrılır. Pozitif katalizör tep-
kimenin aktivasyon enerjisini düşürür. Böylece farklı bir mekanizma
üzerinden yürümesini sağlar. Katalizör, tepkime hızını artırırken tepki-
me sonunda oluşan ürünlerin bileşimini ve verimini değiştirmez.
Tepkimeyi yavaşlatan maddelere inhibitör veya negatif katalizör
denir.
Molekül sayısı Molekül sayısı
Eşik enerjisi Düşük eşik enerjisi
Tepkimeye gir- Tepkimeye gir-
mek için yeterli Eşik enerjisini mek için yeterli Eşik enerjisini
kinetik enerjiye aşan tanecik kinetik enerjiye aşan tanecik
sahip olmayan sayısı sahip olmayan sayısı
moleküller moleküller
E Kinetik enerji E Kinetik enerji
1 2
a) b)
Grafik 5.2.4: Katalizörsüz (a) ve katalizörlü (b) tepkimenin karşılaştırılması
Grafik 5.2.4’ten anlaşılacağı gibi katalizör aktivasyon enerjisinin
değerini düşürür.
209