Page 7 - Fen Lisesi Kimya 9 | 2. Ünite
P. 7
ATOM VE PERİYODİK SİSTEM
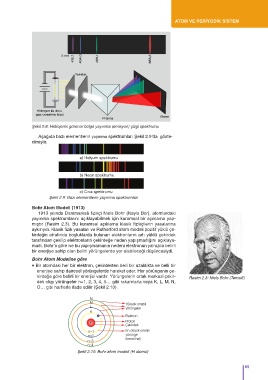
Şekil 2.8: Hidrojenin görünür bölge yayınma (emisyon) çizgi spektrumu
Aşağıda bazı elementlerin yayınma spektrumları Şekil 2.9’da göste-
rilmiştir.
a) Helyum spektrumu
b) Neon spektrumu
c) Cıva spektrumu
Şekil 2.9: Bazı elementlerin yayınma spektrumları
Bohr Atom Modeli (1913)
1913 yılında Danimarkalı fizikçi Niels Bohr (Nayls Bor), atomlardaki
yayınma spektrumlarını açıklayabilmek için kuramsal bir açıklama yap-
mıştır (Resim 2.3). Bu kuramsal açıklama klasik fizikçilerin yasalarına
aykırıydı. Klasik fizik yasaları ve Rutherford atom modeli pozitif yüklü çe-
kirdeğin etrafında boşluklarda bulunan elektronların artı yüklü çekirdek
tarafından çekilip elektronların çekirdeğe neden yapışmadığını açıklaya-
madı. Bohr’a göre ise bu yapışmamanın nedeni elektronun yalnızca belirli
bir enerjiye sahip olan belirli yörüngelerde yer alabileceği düşüncesiydi.
Bohr Atom Modeline göre
■ Bir atomdaki her bir elektron, çekirdekten belli bir uzaklıkta ve belli bir
enerjiye sahip dairesel yörüngelerde hareket eder. Her yörüngenin çe-
kirdeğe göre belirli bir enerjisi vardır. Yörüngelerin ortak merkezi çekir-
Resim 2.3: Niels Bohr (Temsilî)
dek olup yörüngeler n=1, 2, 3, 4, 5… gibi rakamlarla veya K, L, M, N,
O… gibi harflerle ifade edilir (Şekil 2.10).
Şekil 2.10: Bohr atom modeli (H atomu)
64 65