Page 8 - Fen Lisesi Kimya 9 | 4. Ünite
P. 8
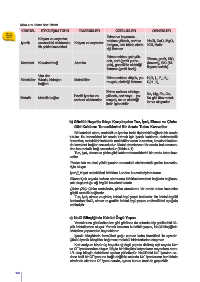
Tablo 4.1: Kristal Katı Türleri
KRİSTAL ETKİLEŞİM TÜRÜ TANECİKLER ÖZELLİKLER ÖRNEKLER
Erime ve kaynama
Katyon ve anyonlar
noktası yüksek, sert ve NaCl, CaO, MgO,
İyonik arasındaki elektrosta- Katyon ve anyonlar
kırılgan, katı hâlde elekt- KCl, NaBr
tik çekim kuvvetleri
riği iletmez.
Erime noktası çok yük-
Elmas, grafit, SiO
sek, sert (grafit yumu- 2
Kovalent Kovalent bağ Atomlar (kuvars), SiC (Si-
şak), genellikle elektriği
lisyum karbür)
iletmez (grafit hariç).
Van der
Erime noktası düşük, yu- H O, I , P , S ,
Moleküler Waals, hidrojen Moleküller 2 2 4 8
muşak, elektriği iletmez. C H O
bağları 6 12 6
Erime noktası oldukça
Na, Mg, Fe, Cu,
Pozitif iyonlar ve yüksek, sert veya yu-
Metalik Metalik bağlar Sn gibi tüm metal-
serbest elektronlar muşak, ısı ve elektriği
ler ve alaşımlar
iletir. İşlenebilir.
b) Günlük Hayatta Sıkça Karşılaşılan Tuz, İyot, Elmas ve Çinko
Gibi Katıların Taneciklerini Bir Arada Tutan Kuvvetler
Bir katıdaki atom, molekül ve iyonlar farklı tiplerdeki bağlarla bir arada
tutulur. Bu tanecikleri bir arada tutmak için iyonik katılarda elektrostatik
kuvvetler, moleküler katılarda moleküller arası kuvvetler, kovalent katılar-
da kovalent bağlar sorumludur. Metal atomlarının bir arada bulunmasın-
dan ise metalik bağ sorumludur (Tablo 4.1).
Tuz, iyot, elmas ve çinko gibi katıların taneciklerini bir arada tutan kuv-
vetler
Tuzlar: Artı ve eksi yüklü iyonlar arasındaki elektrostatik çekim kuvvetle-
riyle oluşur.
İyot (I ): İyot molekülleri birbirine London kuvvetleriyle tutunur.
2
Elmas: Çok sayıda karbon atomunun birbirine kovalent bağlarla bağlana-
rak oluşturduğu ağ örgülü kovalent katıdır.
Çinko (Zn): Çinko metalinde, çinko atomlarını bir arada tutan kuvvetler
güçlü metalik bağlardır.
Tuz, iyot, elmas ve çinko; kristal örgü yapılı katılardır. Bu kristal örgülü
katılardan NaCI, elmas ve grafitin kristal örgü yapısı ve özellikleri aşağıda
verilmiştir.
c) NaCl Bileşiğinin Kristal Örgü Yapısı
Yemek tuzu gözümüze toz gibi görünse de aslında küp şeklindeki kü-
çük kristallerden oluşur. Yemek tuzunun bu kübik yapısı, NaCl bileşiğinin
kristalize yapısından kaynaklanır.
İyonik bileşiklerin formülleri çoğu zaman kaba formülleri ile aynıdır.
Çünkü iyonik bileşikler bağımsız molekül birimlerinden oluşmaz.
Katı sodyum klorür üç boyutlu ağ örgü yapıda dizilmiş eşit sayıda Na +
−
ve Cl iyonlarından oluşur. Böyle bir bileşikte katyonların anyonlara oranı
+
1/1 olup bileşik elektriksel açıdan yüksüzdür. NaCl’deki Na iyonları sa-
− +
dece belli bir Cl iyonuna bağlı değildir; aslında Na iyonlarının her birinin
−
etrafında altı tane Cl iyonu vardır, ayrıca bunun tersi de geçerlidir.
148