Page 59 - Fen Lisesi Kimya 11
P. 59
MODERN ATOM TEORİSİ
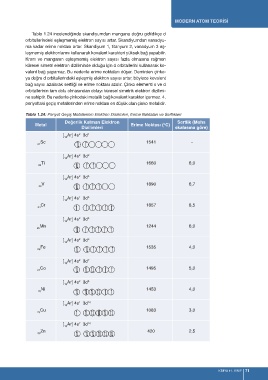
Tablo 1.24 incelendiğinde skandiyumdan mangana doğru gidildikçe d
orbitallerindeki eşleşmemiş elektron sayısı artar. Skandiyumdan vanadyu-
ma kadar erime noktası artar. Skandiyum 1, titanyum 2, vanadyum 3 eş-
leşmemiş elektronlarını kullanarak kovalent karakteri yüksek bağ yapabilir.
Krom ve manganın eşleşmemiş elektron sayısı fazla olmasına rağmen
küresel simetri elektron diziliminde olduğu için d orbitallerini kullanarak ko-
valent bağ yapamaz. Bu nedenle erime noktaları düşer. Demirden çinko-
ya doğru d orbitallerindeki eşleşmiş elektron sayısı artar, böylece kovalent
bağ sayısı azalarak sertliği ve erime noktası azalır. Çinko elementi s ve d
orbitallerinin tam dolu olmasından dolayı küresel simetrik elektron dizilimi-
ne sahiptir. Bu nedenle çinkodaki metalik bağ kovalent karakter içermez. 4.
periyottaki geçiş metallerinden erime noktası en düşük olan çinko metalidir.
Tablo 1.24: Periyot Geçiş Metallerinin Elektron Dizilimleri, Erime Noktaları ve Sertlikleri
Değerlik Katman Elektron Sertlik (Mohs
o
Metal Erime Noktası ( C)
Dizilimleri skalasına göre)
[ Ar] 4s 3d 1
2
18
Sc 1541 -
21
[ Ar] 4s 3d 2
2
18
Ti 1660 6,0
22
2
[ Ar] 4s 3d 3
18
V 1890 6,7
23
1
[ Ar] 4s 3d 5
18
Cr 1857 8,5
24
2
[ Ar] 4s 3d 5
18
Mn 1244 6,0
25
[ Ar] 4s 3d 6
2
18
Fe 1535 4,0
26
2
[ Ar] 4s 3d 7
18
Co 1495 5,0
27
[ Ar] 4s 3d 8
2
18
Ni 1453 4,0
28
1
[ Ar] 4s 3d 10
18
Cu 1083 3,0
29
[ Ar] 4s 3d 10
2
18
Zn 420 2,5
30
71
KİMYA 11. SINIF